
|
Experiment des Monats
|
Die ersten endothermen Reaktionen zwischen Salzen wurden im 19. Jhd. von J. H. VAN'T HOFF beobachtet. In der Folgezeit wurden zahlreiche unterschiedliche Gemische untersucht. Sie beruhen überwiegend darauf, dass kristallwasserreiche Salze umgesetzt werden, wobei das Kristallwasser frei wird. Bei der hier vorgestellten Reaktion läuft eine Redox-Reaktion ab, bei der elementarer Schwefel entsteht.
 |
 |
 |
Geräte und Chemikalien:
Eisen(III)nitrat-Nonahydrat,
Natriumthiosulfat-Pentahydrat
Bechergläser, Thermometer.
Durchführung:
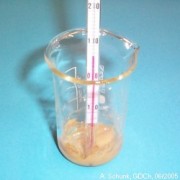
In einem Becherglas 10,1 g (0,025 mol)
Fe(NO3)3·9H2O
mit 9,3 g (0,0375 mol)
Na2S2O3·5H2O
als Feststoffe mischen. Es entsteht nach kurzer Zeit eine
Suspension, in der hellgelber Schwefel und dunkelbraunes
Eisenhydroxid gut zu erkennen sind. Mit einem Thermometer
wird die Temperaturänderung gemessen. Sie beträgt bei
den angegebenen Substanzmengen etwa –20 K, die Temperatur sinkt
also beispielsweise von 20°C auf ca. 0°C. (Bei der abgebildeten
Durchführung wurde bei einer kleineren Substanzmenge ein Absinken
auf +6°C beobachtet.)
Für ein optimales Ergebnis sollten zwei ineinander gestellte
Bechergläser mit einer dazwischen liegenden Isolierschicht
(z.B. aus Styropor) verwendet werden.
Erklärung:
Der zentrale Prozeß ist der Zerfall von Thiosulfat in Schwefeldioxid
und elementaren Schwefel. Die Triebkraft der Reaktion ist die Freisetzung
des Kristallwassers der beiden eingesetzten Salze und die Entstehung des
gasförmigen SO2. Die Zahl der Teilchen und damit die Entropie
nimmt dabei erheblich zu. (vgl. EdM 07/2003)
Dies führt dazu, daß der endotherme Prozeß freiwillig
und spontan abläuft.
2 Fe(NO3)3·9H2O +
3 Na2S2O3·5H2O
 2 Fe(OH)3 +
6 NaNO3 + 3 SO2 +
3 S + 30 H2O
2 Fe(OH)3 +
6 NaNO3 + 3 SO2 +
3 S + 30 H2O
Gefahren:


Das bei der Reaktion entstehende Schwefeldioxid wirkt ätzend bzw. reizend.
Eisennitrat ist, wie alle Nitrate, brandfördernd.
Entsorgung:
Die Rückstände werden zum Schwermetall-Abfall gegeben.
Literatur & Links:
Heinz Schmidkunz: "Neue spontane endotherme Reaktionen kristalliner Substanzen"
Chemkon, 9 (2002), 175-178
Mai 2005: Der Baumannsche Versuch
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Dienstag, 31. Mai 2005, A. Schunk, GDCh, Frankfurt/Main.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!