
|
Experiment des Monats
|
Säure-Base-Indikatoren zeichnen sich durch eindrucksvolle Farbwechsel aus. Durch Indikatoren sichtbar gemachte Säure-Base-Reaktionen sind daher für eine Projektion besonders geeignet. In Petrischalen durchgeführt, gibt es für derartige Reaktionen zahlreiche Variationsmöglichkeiten.
 |
 |
 |
Geräte und Chemikalien:
Petrischalen
Methylrot,
Bromthymolblau,
Thymolblau,
verdünnte Salzsäure,
verdünnte Natronlauge,
Natriumhydrogensulfat,
Natriumcarbonat.
Durchführung:
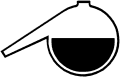
Variante 1: Petrischale 2-3 mm hoch mit Wasser füllen.
An gegenüberliegenden Stellen der Schale am Rand einige Tropfen zweier
unterschiedlicher Indikatoren sowie unter 90° einige Tropfen Salzsäure
bzw. Natronlauge zugeben. Durch Diffusion bilden sich unterschiedlich gefärbte
Zonen aus. Im abgebildeten Beispiel (linkes Bild) wurden Methylrot und
Bromthymolblau verwendet.
Variante 2: Zu einer stark verdünnten Natronlauge einige Tropfen Thymolblau-Lösung geben und damit eine Petrischale 2-3 mm hoch füllen. In die Mitte einige Kristalle Natriumhydrogensulfat geben. Durch das saure Salz schlägt der Indikator in der Umgebung der Salzzugabe um.
Variante 3: Die Petrischale mit einer schwach salzsauren, mit Thymolblau gefärbten Lösung füllen. In das Zentrum einige Körnchen Soda geben.
Es gibt bei diesen Versuchen unzählige Variationsmöglichkeiten. Besonders effektvoll sind Indikatoren, die mehrere Umschlagbereiche besitzen (Thymolblau) oder Indikatorgemische (Universalindikator, Bromthymolblau + Methylrot, Mischindikator etc.).
Erklärung:
Säure-Base-Indikatoren sind schwache Säuren oder Basen.
Sie zeichnen sich dadurch aus, daß die protonierte und die
deprotonierte Form unterschiedlich gefärbt sind.
HInd + H2O
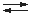 Ind– + H3O+
Ind– + H3O+
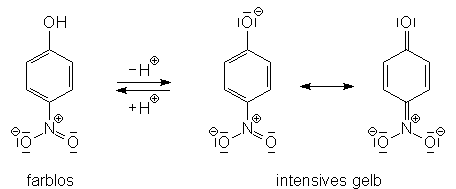
Meist handelt es sich bei Indikatoren um aromatische Moleküle mit polaren Substituenten, die dissoziieren können. Durch die Dissoziation können sich beispielsweise chinoide Systeme ausbilden, deren Absorptionsbereich in einem anderen Bereich des Licht-Spektrums liegt, als der des nicht dissoziierten Moleküls. Als Beispiel für einen Indikator ist hier p-Nitrophenol angegeben:
Salze schwacher Säuren (Carbonate, Acetate etc.) reagieren basisch. Die Anionen werden in wässriger Lösung teilweise protoniert, es entstehen Hydroxidionen, der pH-Wert steigt.
CO32– + H2O
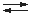 HCO3– + OH–
HCO3– + OH–
Monosalze von mehrprotonigen Säuren (z.B. Hydrogensulfate) reagieren dagegen sauer, da die Hydrogensulfat-Ionen nochmals Protonen abgeben können.
HSO4– + H2O
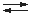 SO42– + H3O+
SO42– + H3O+
Auch Aluminium- und Eisen(III)-Salze reagieren sauer. Wassermoleküle der Hydrathülle dieser Ionen können dissoziieren:
[Al(H2O)6]3+
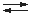 [Al(H2O)5(OH)]2+ + H+
[Al(H2O)5(OH)]2+ + H+
Gefahren:

Salzsäure und Natronlauge sind ätzend.
Entsorgung:
Die Lösungen können zum Abwasser gegeben werden.
Literatur & Links:
Roland Full: "Lichtblicke - Petrischalenexperimente in der Overheadprojektion",
Chemie in unserer Zeit, 30 (1996), 286-294
Christoph Straube & Rüdiger Blume:
Die Indikator-Schul-Webseite
(Didaktik der Chemie, Univ. Bielefeld)
Neu: Register zu den bisherigen Experimenten
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Sonntag, 29. Oktober 2000, A. Schunk.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!